β-支链取代的羧酸衍生物在有机合成和药物化学中是一类优势骨架,合成含有该骨架分子的一个挑战是如何引入位阻比较大的侧链。于近期,黄湧/陈杰安课题组报道了通过有机小分子催化的四组分自由基串联偶联反应,将简单易得的试剂转化为一系列β-叔碳-γ-季碳羧酸衍生物。该策略是对经典的双电子极性机理的补充,对于β-位点引入季碳取代基有较高效率。从机理方面而言,氮杂环卡宾(NHC)与烯醛形成的高烯醇负离子参与的自由基串联反应存在位点选择性和催化剂循环再生两个挑战。研究团队发现,用三氮唑类卡宾催化剂可以高效控制反应位点选择性,进一步基于前期报导的“瞬间稳态”酰基捕获策略(Angew. Chem. Int. Ed., 2018, 57, 8503),可一锅法制备多样化的羧酸衍生物。文章在线发表于《ACS Catalysis》上,题为: An N-Heterocyclic carbene-catalyzed four-component reaction: chemoselective Cradical-Cradical relay coupling involving the homoenolate intermediate (ACS catal., 2021, 11, 10123-10130. DOI: 10.1021/acscatal.1c02576)。
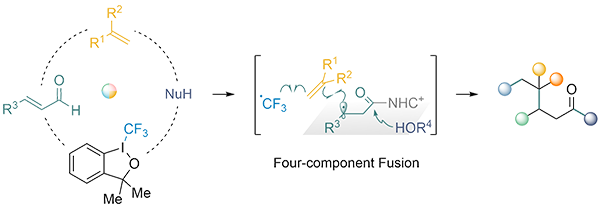
最近几年,氮杂环卡宾介导的自由基化学备受关注,绝大部分工作聚焦于由醛和氮杂环卡宾形成的Breslow中间体所导向的酰基自由基(ketyl)(图1a)。2019年,Ohmiya课题组率先报道了通过这一酰基自由基诱导的自由基偶联反应来合成酮,之后该组实现了该体系与烯烃的三组分自由基串联偶联反应。受这一体系启发,其他课题组先后实现了一系列常用单电子氧化剂与Breslow中间体发生的自由基(串联)偶联反应。与此同时,Scheidt课题组发展了一种相反的策略来得到酰基自由基,即酰基自由基产生于光氧化还原催化的酰基三氮唑类中间体与还原剂/自由基前体。但到目前为止,氮杂环卡宾高烯醇负离子中间体介导的自由基反应报道极少,只有和氧自由基以及缺电子碳自由基发生的偶联(图1b)。
图1. 涉及NHC-enolates的自由基反应
基于此,研究团队选择亲电的三氟甲基试剂作为单电子氧化剂来产生高烯醇自由基,经过反应条件的正交筛选,确定反应的最优条件,即肉桂醛作为高烯醇负离子前体,Togni I作为三氟甲基化试剂,1,1-二苯基乙烯作为自由基relay,三氮唑卡宾作为催化剂,甲醇作为氮杂环卡宾催化剂的循环试剂。反应底物普适性探索中发现,肉桂醛苯环上对位、间位、邻位上不同电性取代基都可以很好地兼容于反应。除此之外,β-杂芳烃、烯烃以及烷基取代的烯醛,携带复杂骨架的烯醛,均可顺利实现目标化学转化。对于烯烃底物,不同取代的1,1-二芳基乙烯,杂芳烃、烷基取代的1,1-二取代乙烯都可以兼容。单取代的苯乙烯也可以得到39%的目标产物,dr值为1:1,相关的非对映选择性研究正在持续进行。最后,研究团队对氮杂环卡宾催化剂的循环亲核试剂进行拓展。除了甲醇,大部分一级醇都可以实现反应的循环,合成一系列不同的酯类衍生物。基于研究团队之前发展的策略,“瞬时稳态”酰基捕获剂(吡唑或者咪唑)的引入可导向高反应活性的酰基吡唑、酰基咪唑中间体,与后续引入的脂肪胺、酰肼、苯酚、过氧醇或者苯硫酚反应,一锅法合成一系列羧酸衍生物。
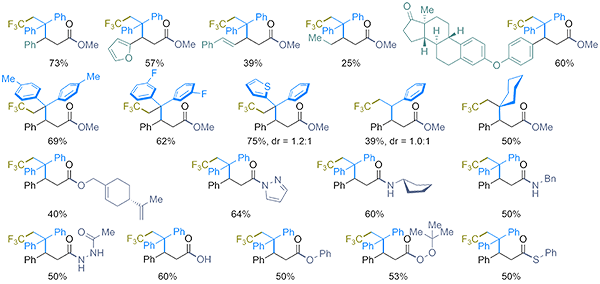
图2. 代表性结构骨架
研究团队同时对反应的机理进行研究,TEMPO(图3a)及“自由基钟”实验(图3b)均支持自由基反应途径的可能性。同时,北京大学深圳研究生院/深圳湾实验室的张欣豪教授团队对三氮唑及噻唑氮杂环卡宾分别形成的高烯醇负离子进行电子自旋密度分布的理论计算,结果表明自由基在C3位置上的分布明显高于C1位置,很好地契合反应位点选择性的表观(图3c)。
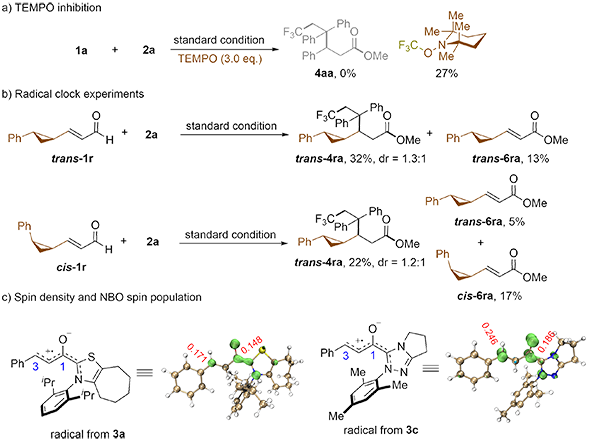
图3. 实验机理研究
以上工作由香港科技大学黄湧教授/深圳湾实验室陈杰安研究员共同指导,由北京大学深圳研究生院李镇博士完成实验部分,理论计算部分由北京大学深圳研究生院/深圳湾实验室张欣豪教授与学生黄美蓉完成,依托于省部共建肿瘤化学基因组学国家重点实验室,得到了国家自然科学基金委员会、广东省自然科学基金委员会、深圳市科技创新委员会和香港研究资助局的资助。(文字:陈杰安/李镇)

