在诸多有机催化范式中,杂原子手性中心的构建是化学家最为关注的命题之一。有望通过不对称共轭加成反应归一化处理的元素,包括了N、O、P、S、Se等,这系列物种均存在与氢原子的共价键(X-H),亦即可能基于HOMO-raising策略,通过手性质子碱催化剂形成氢键,以非共价活化的形式实现不对称加成反应,构建杂原子手性中心。从金鸡纳碱类化合物引领的钩深致远开始,桥头氮(以及系列三级胺模块)便不断取得开创性进展,进而突破此类化合物内源质子碱性的桎梏,引入胍、环丙亚胺及膦亚胺等模块开辟“超强碱”催化理念,反应底物之间的正交组合不断延展。然而,理论可行的几类杂原子试剂仍属于甚少开发之列,例如烷基胺、醇、硫醇、硒醇等。2014年,由黄湧/陈杰安课题组首次实现氮杂环卡宾(N‑heterocyclic carbenes, NHCs)的手性Brønsted base角色扮演(Nat. Commun. 2014, 5, 3437),并逐步实现脂肪硫醇及一级脂肪胺的不对称共轭加成反应(Angew. Chem. Int. Ed. 2015, 54, 15414; Chem. Sci. 2015, 6, 4184; Synlett 2016, 27, 1068; Sci. China Chem. 2016, 59, 251; N-Heterocyclic Carbenes in Organocatalysis, Wiley-VCH, Weinheim, 2019, 261-286)。从理化性质而言,卡宾中心相邻的氮原子同时具备σ-吸电子及π-供电子的属性,使得其相较于有机“超强碱”具有优势的σ-电子供给能力,且氮原子可通过取代基效应实现NHC整体电性的调节,因而催化剂前体(亦即卡宾的共轭酸)具有稍宽的pKa阈值空间(16-18)。此外,处于闭环骨架内的卡宾中心在过渡态所营造的手性环境更具刚性,可以有效控制底物成键过程的对映选择性。
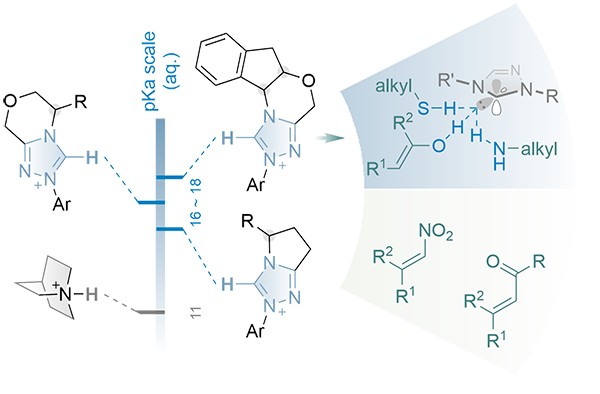
研究团队在前期研究工作中发现,双取代氮源亲核试剂的不对称共轭加成反应存在较大挑战,已报导文献亦甚少涉及经由此策略构建的α-手性三级胺。研究团队借鉴金鸡纳碱催化剂家族的双官能团化进化途径,在常规三氮唑氮杂环卡宾的骨架基础之上,额外引入(硫)脲模块作为氢键供体(H-bonding donor, HBD),设计了双功能(硫)脲-氮杂环卡宾催化剂前体(NHC-HBD),并成功应用于非共价不对称催化模型中,实现二级胺的不对称aza-Michael反应,高效合成α-手性三级胺类化合物。成果在线发表于《ACS Catalysis》,题为“A Bifunctional N‑Heterocyclic Carbene as a Noncovalent Organocatalyst for Enantioselective Aza-Michael Addition Reaction”(ACS Catal. 2021, 11, 6316-6324. DOI: 10.1021/acscatal.1c01908)。
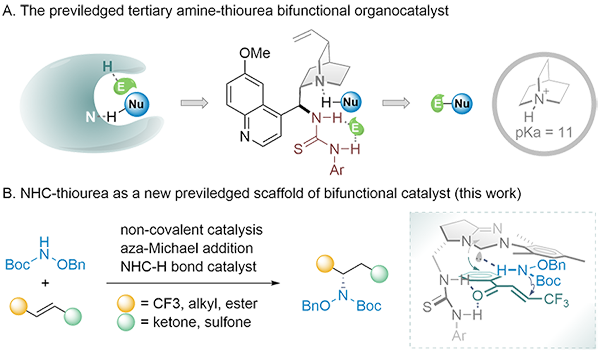
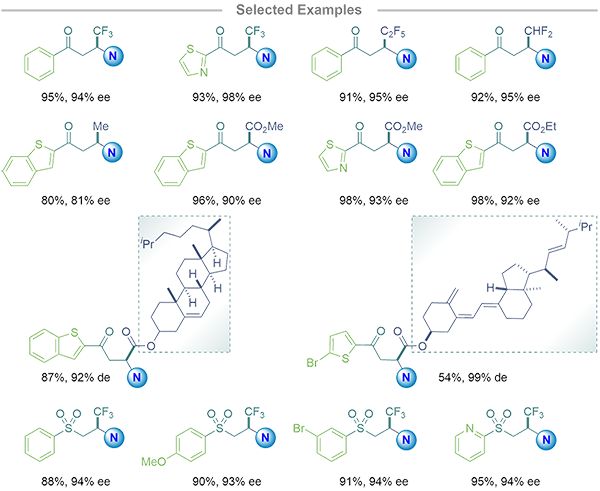
机理实验表明,在模版反应中双官能团化的NHC-HBD催化剂相较于经典催化体系,可提供更高的反应活化能及有效的面选择性控制,并且HBD基团上的两个质子至关重要。整个催化体系的底物普适性较强,可同时匹配多类Michael受体:β-CF3烯酮、β-烷基烯酮、β-酯烯酮及磺酰烯烃等,均可获得较优的反应转化率及对映选择性,进一步拓宽了NHCs非共价活化机制的普适性,同时验证了双官能团化NHC-HBD的应用潜力。对于更具挑战性的不对称C-P、C-Se及C-O成键,研究团队正在推进相关研究工作,并已获得重要结果,以期在NHCs非共价的不对称活化模版之上,实现更多类别的含杂原子手性中心构建。
以上工作由香港科技大学黄湧教授/深圳湾实验室陈杰安研究员共同指导,由北京大学深圳研究生院博士研究生郭芳芳完成,依托于省部共建肿瘤化学基因组学国家重点实验室,得到了国家自然科学基金委员会、广东省自然科学基金委员会、深圳市科技创新委员会和香港研究资助局的资助。(文字:陈杰安/郭芳芳)

